先日、”論理が伝わる世界標準の「書く技術」”を読みました。

https://bookclub.kodansha.co.jp/product?item=0000194754 ←講談社bookクラブHP
倉島保美という方が日本では馴染みがない、ライティングという学問についてパラグラフの書き方を中心に論じている本です。実は書く技術は欧米ではライティングとして大学で体系的に学ぶものだそうです。やはり色んな人種や国籍の人たち同士がわかりあうために論理的な伝え方、というのが日本に比べて必要なのでしょうか。僕は現在大学院生で臨床研究と基礎研究の両方している身ですが、卒業後も(卒業できるかは置いといて)何かしらの研究活動を続けたいと思っていますし、その為には研究内容をわかりやすく他人、できれば世界に伝える必要があるとヒシヒシと感じています。今まで教授を始め、色んな人の助けを借りて論文3編、国際学会発表1回、国内学会発表3回と経験してきていますが論文執筆や発表の独自のメソッドはなく、いつも行き当たりばったりでした。今後自力でもやらなければいけないとなると体系的に書く技術の必要性も感じていたところに丁度本書と出会ったのです。
今回は内容を備忘録的な意味も込めてまとめてみます。今回の内容は徹底的に伝わりやすさ、を重視しています。全編において読者は読むことによって初めて内容を知ることができる、という基本に立ち返っています。3部制で1部で学ぶ意味、2部で具体的な書き方、3部で例題といった構成でした。今回は主に2部を取り上げます。2部は7つのテーマでパラグラフの書き方を説明していますが、内容的に大きく3つに分けてみました。1つ目は「1つのパラグラフでは1つのトピックについて書く」、「パラグラフは要約文から始める」といったパラグラフの働きや役割について、そして2つ目は「パラグラフを接続する」、「総論のパラグラフを最初に作る」などの文章全体におけるパラグラフの役割、さらに3つ目としては「補足情報で補強する」、「パラグラフを揃えて表現する」、「既知から未知の流れでつなぐ」のようなパラグラフ具体的な書き方です。それぞれのテーマについて具体的に例題もありつつ説明されており、わかりやすかったです。が、例題についてはかったるさもあって今回はチャレンジしませんでした。上の順番は実際の順番とは違いますが個人的な理解のしやすい順に改変しています。以下にそれぞれの説明をしていきます。よろしくお願いします。
まず、1つのパラグラフでは1つのトピックについてのみ書いています。これはそこはかとなく知ってはいたが、改めて文字にされると実は一番重要ではないかと思っています。このルールについては文章を読むにあたって、読者側としても認識しておかなければいけない点です。1つのパラグラフに1つのトピックについてのみ記載している、と理解している読者はパラグラフに1つのトピックがあると思って読んでいるので(当たり前ですが、、)トピックが2つ以上になってしまうとその時点でうまく文章が追えなくなってしまいます。このパラグラフにおいてもパラグラフ繋がりでパラグアイのことについて書いてしまうと変ですよね。(なんなら繋がっていない。)
そしてパラグラフはその1つのトピックについての要約文で始めるものとされています。1つのパラグラフに1つのトピックなので最初にこのパラグラフで説明するトピックについての要約文で始めることによって、読者に「ああ、このパラグラフはこのトピックについて書くんだな」と最初に思わせることができます。最後に要約文を持ってくる手法もありますがそれは文学的であったり、ミステリーであったり、発表であったりのやり方です。最後に持ってきていいのは最後まで聞いてくれると決まっている時だけです。文章においてはどの時点でも終わらせれても伝わるように書くのが大事です。
ということは要約文をつなげることで、その文章全体がわかります。1つのパラグラフでは1つのトピックについてしか書かないし、そのトピックの要約はパラグラフの最初にあるはずなので、パラグラフの最初の要約文のみ集めて読めばその文章のだいたいの内容は理解できるはずです。いや、理解できるようにパラグラフを組み立てることが必要です。
文章全体をわかりやすくするためのパラグラフの繋げ方としては引き継ぎ型と展開型の二つがあります。引き継ぎ型は縦につなげるパターンです。パラグラフ内で新しく出た内容を次のパラグラフで説明していきます。展開型は先に幾つかの内容を羅列し、その後それぞれのパラグラフで説明していくパターンです。この二つのパターンのどちらかにすることでスムーズに論理が形成されていきます。
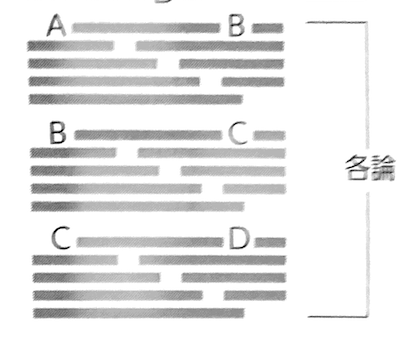 引き継ぎ型イメージ
引き継ぎ型イメージ
 展開型イメージ
展開型イメージ
そして文章全体についての総論のパラグラフを最初に作るとさらにわかりやすいです。総論を最初に書くことによってその文章全体についてのイメージを読者に作ることができます。なんなら読者はその場で読むのをやめても内容は伝わっているという寸法です。さらに書く側としても総論を書いてその内容をトピック毎にパラグラフに書いていけばいいので書きやすくもなるというお得感があります。
一方でパラグラフ内の内容を充実させることも必要であります。一般的にパラグラフは4−8行の文で形成されるのが望ましいとされています。トピックの文だけ書いてちょろっと補足して2行でおしまい、は許されません。そうならないための具体的な方法として3つヒントがあります。それはwhat、why、howです。whatでまずそのトピックの意味を説明します。どういう意味なのかをわかりやすく説明するのです。そしてその次にwhyでなぜ、そのトピックは正しいのかを説明します。対立項目との比較など使って具体的に説明するとなおよしです。さらにhowでそのトピックがどれだけ重要かを説明します。具体的なデータなどを使うとエクセレントです。僕はこの3つのヒントでかなり文章が書けるようになった気がします。(まだ具体的には書いてませんが、、、、書いてないんかーい)
そして充実した内容は書き方を揃えることによってさらに伝わりやすくなります。例えば肉の文章で豚と牛と鳥についてそれぞれのメリットを説明するパラグラフを書くとします。豚と牛について値段、質感、味について説明して鳥では値段、質感、味に加えて食べやすさについて説明したとすると、豚と牛についての食べやすさは?となります。このように比較するときなどはなおさら書き方について揃えるとわかりやすくなります。それ以外についても基本的に先ほどの3つのヒント(what、why、how)に沿って書くとわかりやすいと思います。
書き方をそろえるのと同じように情報の出し方も揃えた方がいいです。具体的には既知から未知の流れで繋げると良いです。出し方としては3つあります。引き継ぎ型、展開型、統一型です。引き継ぎ型と展開型はパラグラフの繋げ方と同じです。統一型は最初にAと出してから、Aについては●です。Aはさらに▲です。Aはそんでもって□です。のように後からたくさん説明していくパターンです。ここについては読者はやはり知らないことをいきなりいっぱい言われるより、知っていることが徐々に増える方がわかりやすい、という読者目線を忘れないというのが重要なことなのかなと思いました。
以上、それぞれパラグラフとして書いてみました。今回の文章がわかりやすかったらこの本を読んだ意味がありますし、あまりわかりにくかっても本自体はわかりやすいのでおすすめです。
最後に僕が気に入ったあとがきからの引用です。なぜ日本の大学で文章の書き方を指導しないのですかと聞かれた時の著者の回答です。理由は2つだそうです。1つはコミュニケーションを重視しない文化だから、農耕民族なのでコミュニケーションが密でなくても食にありつけたのだからではないだろうか。2つ目は正しい書き方を指導されると困る方が少なからずいるから、実は大学で指導する立場でも正しく書けていない人が多いので書き方の指導ができない、もしくはすると困るということです。
理由はともかくサイエンスの本場が欧米な限り、彼らが大事にしているライティングについて知っておくのは必要なのかなと思います。










